Viimase aastakümne jooksul on meie teadmised inimese geenidest ja nende variatsioonide seostest eri tunnuste ning haigustega kasvanud eksponentsiaalselt. Nüüdseks on kindlaks tehtud juba tuhanded geneetilised muutused, mis on seotud eri tunnuste, haiguste ja isegi ravimite kõrvaltoimetega. Aga miks ei ole see informatsioon veel kliinilises praktikas kasutusse jõudnud?
Siinkohal tuleb selgelt eristada monogeenseid haigusi ja kompleks- ehk multifaktoriaalseid haigusi. Arenenud riikides üle kogu maailma on monogeensete haiguste geneetika tänapäeva meditsiini väga oluline osa. Selliseid haigusi on enamjaolt suhteliselt lihtne uurida: kui ühes geenis on kodeeritavat valku rikkuv mutatsioon, saavad arstid suure kindlusega öelda, et see muutus põhjustabki haigust. Komplekshaiguste puhul, nagu ka nimi ütleb, mõjutavad haiguse avaldumist paljud faktorid, sealhulgas kümned geenivariandid kombineerituna inimese elustiili ja keskkonnateguritega. Nende haiguste puhul on võimalik hinnata vaid haigestumisriski, võttes arvesse kõik teadaolevad riski mõjutavad faktorid.
Paljude geenivariantide ehk alleelide mõju arvesse võtmiseks on võimalik arvutada geneetiline riskiskoor, milleks summeeritakse eri geenivariantide mõjud. Praeguseks on ilmunud ridamisi uusi teaduspublikatsioone, kus on uuritud geneetilise riskiskoori seotust haigestumisega. Värskelt The Lanceti ajakirjas ilmunud artiklis1 näitasid Harvardi ülikooli kardioloogid, et kõrge geneetilise riskiga inimestel oli 70% suurem risk haigestuda südame isheemiatõppe ja selle ägedaimasse avaldumisvormi ehk südamelihase infarkti kui neil, kelle geneetiline risk oli madal. Lisaks leiti, et kõrge geneetilise riskiskooriga inimeste seas oli vere kolesteroolitaset langetavate statiinide manustamine südame isheemiatõve ennetamiseks kõige tõhusam. Teises sarnases artiklis2 uuriti 65 markerist koosneva geneetilise riskiskoori mõju teist tüüpi diabeeti haigestumisele ning leiti, et 20%-l kõige kõrgema geneetilise riskiga inimestel oli 2,7 korda suurem risk haigestuda, võrreldes nendega, kes olid 20% kõige madalama geneetilise riskiga inimeste seas. Lisaks on ilmunud veel mitmeid taolisi artikleid selliste haiguste kohta nagu rinnavähk, reumatoidartriit ja glaukoom.
Riskiskoori hindamine
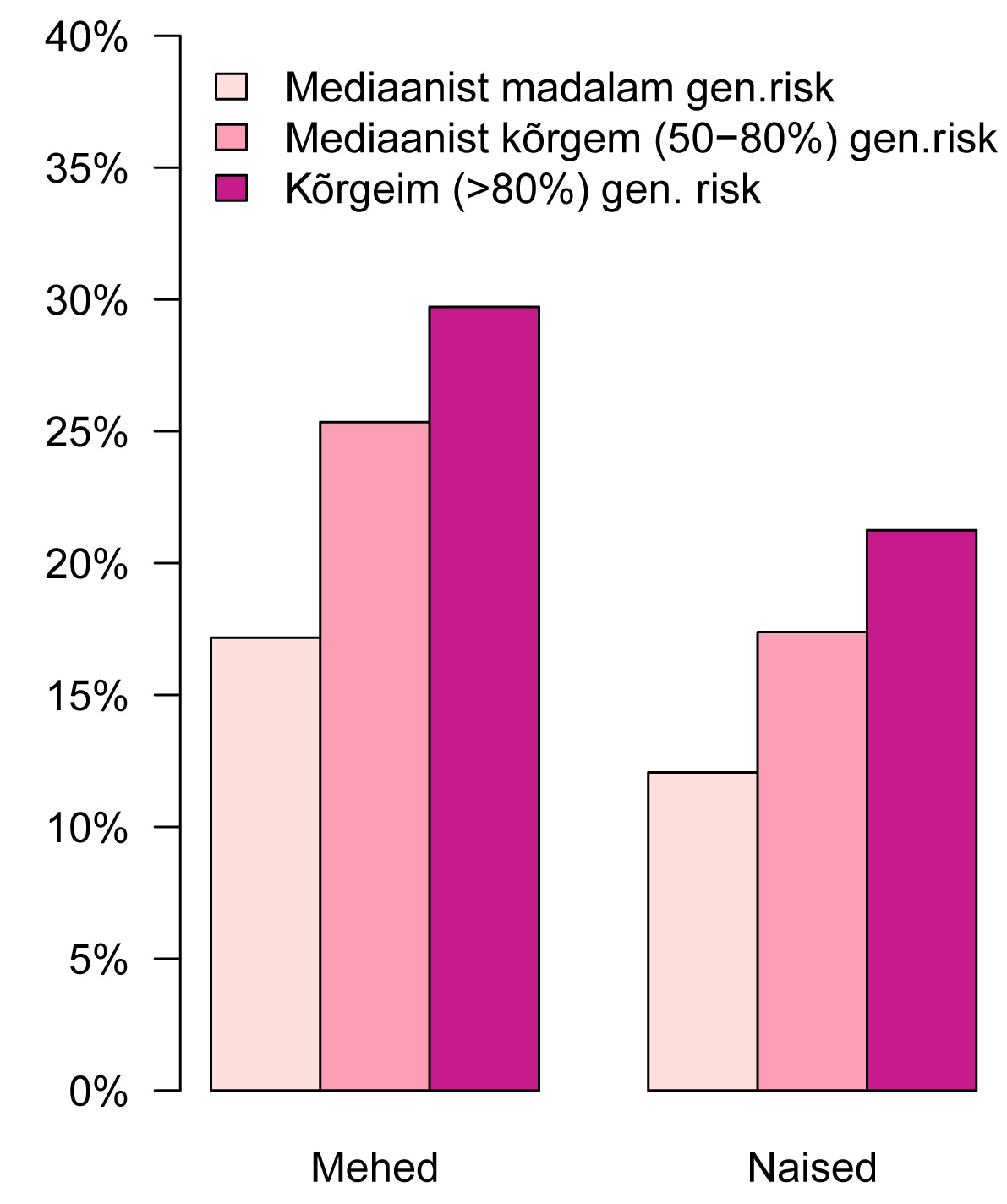
 Tartu ülikooli Eesti geenivaramu (TÜ EGV) vanemteadur Krista Fischer ja tema doktorant Kristi Läll töötavad samuti aktiivselt geneetiliste riskiskooride arvutamisega krooniliste haiguste jaoks. Näiteks südame isheemiatõve – peamise surmapõhjuse – puhul on näha, et kõrge geneetilise riskiga geenidoonorite seas esineb haigust oluliselt rohkem (joonis 1). Keskealiste ja vanemate meeste (vanuses 45–79) seas, kelle geneetiline risk jääb allapoole mediaani, on südame isheemiatõve esinemissagedus alla 20%, naistel (vanuses 50–84) alla 15%. Kõrgeima 20% riskiskooriga geenidoonorite seas esineb sama haigus aga ligi 34 %-l meestest ja enam kui 20%-l naistest.
Tartu ülikooli Eesti geenivaramu (TÜ EGV) vanemteadur Krista Fischer ja tema doktorant Kristi Läll töötavad samuti aktiivselt geneetiliste riskiskooride arvutamisega krooniliste haiguste jaoks. Näiteks südame isheemiatõve – peamise surmapõhjuse – puhul on näha, et kõrge geneetilise riskiga geenidoonorite seas esineb haigust oluliselt rohkem (joonis 1). Keskealiste ja vanemate meeste (vanuses 45–79) seas, kelle geneetiline risk jääb allapoole mediaani, on südame isheemiatõve esinemissagedus alla 20%, naistel (vanuses 50–84) alla 15%. Kõrgeima 20% riskiskooriga geenidoonorite seas esineb sama haigus aga ligi 34 %-l meestest ja enam kui 20%-l naistest.
Et südame isheemiatõve geneetiliste riskiskooride ennustusvõimet veel paremini hinnata, on uuritud ka pärast geenivaramuga liitumist diagnoositud südamelihase infarkti andmeid, mis on saadud haigekassa andmebaasist.
Joonisel 2 on toodud mediaanist madalama (< 50%), mediaanist kõrgema (50–80%) ja 20% kõrgeima geneetilise riskiga meeste kumulatiivne risk haigestuda ning näha on pärast geenivaramuga liitumist lisandunud südamelihase infarkti diagnooside arv igas grupis. Lühikesest jälgimisajast hoolimata on kõrgeim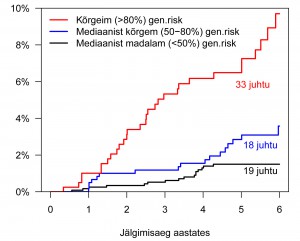 a geneetilise riskiga geenidoonorite seas oluliselt rohkem infarkte (kuue aasta jooksul hinnanguliselt ligi 10%) võrreldes madalama geneetilise riskiga isikutega (ca 2%, statistilist olulisust iseloomustav p-väärtus = 4.3*10-9).
a geneetilise riskiga geenidoonorite seas oluliselt rohkem infarkte (kuue aasta jooksul hinnanguliselt ligi 10%) võrreldes madalama geneetilise riskiga isikutega (ca 2%, statistilist olulisust iseloomustav p-väärtus = 4.3*10-9).
Arstid diagnoosivad ja ravivad kroonilisi haigusi aktiivselt. Perearsti tasandil tegeletakse ka krooniliste haiguste ennetusega. Praegu kasutusel olevad testid, nagu näiteks mammograafia, veresuhkru või autoantikehade taseme mõõtmine, on aga võrreldavad vihmasaju ennustamisega siis, kui õues juba tibutab. Rinnavähk on üks väheseid haigusi, mille varajaseks diagnoosimiseks on rakendatud ennetavaid sõeluuringuid. Kuigi Eestis kontrollitakse sõeluuringul kõiki 50–65-aastaseid naisi, pole see tegevus siiski nii efektiivne, kui võiks oodata – vaid 14% aastatel 2004–2008 diagnoositud rinnavähi juhtudest tabati rutiinse sõeluuringu käigus. Arvestades sõeluuringuteks olemasolevaid vahendeid, oleks võimalik kutsuda kõrge geneetilise riskiga naisi uuringule nooremas eas – seda madalama geneetilise riskiga naiste arvelt, viimaseid on mõttekam jälgima hakata alles kõrgemas eas.
On täiesti arusaadav, et perearst ei jõua kõiki oma nimistus olevaid patsiente iga haiguse ennetamiseks jälgida. Kui tal aga oleks üks lihtne vahend, mille abil tuvastada väga kõrge haigusriskiga inimesi ja nõustada neid enne, kui haigused avalduma hakkavad, oleks tal võimalik teha ennetustööd praegusest tunduvalt tõhusamalt. Tänapäeval on patsiendid ise väga huvitatud oma tervise jälgimisest ja soovivad olla kaasatud. Arvestades tervisliku eluviisi suurt mõju haiguste mitteavaldumisele, on võimalik arendada nutilahendusi, kus inimese personaalne risk visualiseeritakse vastavalt sisestatud geneetilisele riskile (mida ei ole võimalik muuta), kehamassiindeksile, vererõhule ja suitsetamisele, lisaks võetakse arvesse veel teisi tervisenäitajaid. Sellisel viisil näeb inimene ise selgelt, kui oluliselt vähendab kehakaalu langetamine 10 kg võrra ja/või suitsetamise mahajätmine tema haigusriski. Ehk aitab selline info midagi tema käitumises muuta.
Geenikaart saja euroga
Eesti haigekassa ja maailmapanga põhjalik Eesti tervishoiu analüüs näitas, et krooniliste haiguste (teist tüüpi diabeet, südame-veresoonkonna haigused jne) ennetus ja ravi ei ole piisavad. Uuring tõi välja esmatasandi arenguvõimalusi, kus hoolimata sagedastest kontaktidest perearstiga ei pääse patsiendid piisavalt ligi ravijuhendites ette nähtud ennetavatele teenustele krooniliste haiguste vältimiseks. Vastusena analüüsis välja toodud probleemile plaanitakse arendada uusi lahendusi ravijuhendite järgimiseks, mille seas on kindlasti ka perearsti tööd lihtsustavad otsustustoe lahendused.
Eestil on võimalus olla maailmas esimeste riikide seas, kus krooniliste haiguste ennetamiseks võetakse kasutusele geneetilisel informatsioonil põhineva riski arvutamine, kõik eeldused selleks on meil olemas. Võrreldes praegu kasutusel olevate riskihindamise meetoditega on selle meetodi suurim eelis eelkõige võimalus keskenduda kõrge riskiga inimestele ja nende nõustamisele tervisekäitumise teemadel, tehes seda varakult – enne, kui praegu kasutusel olevad riskikalkulaatorid hakkavad reageerima ebatervisliku elustiili tulemusena saadud näitajatele.
Aga mida on juba praegu võimalik teha, et sinna jõuda? Eesti geenivaramu esitas äsja Euroopa Liidu teadus- ja innovatsiooniprogrammi „Horizon 2020“ raames granditaotluse, kus koostöös 14 partneriga üle Euroopa tehti ettepanek hinnata geneetilise riski kasutamise efektiivsust krooniliste haiguste ennetamiseks. Efektiivsuse all peetakse silmas haiguste ennetamist ja selle kulutõhusust, arvestades geneetilise testimise ja nõustamise lisakulu võrdluses haige ravimiskuludega. Samas voorus on ka kolleegid Rootsist ja Hollandist esitanud sarnase taotluse hindamaks farmakogeneetika (ravimite määramisel geneetilise variatsiooniga arvestamine) rakendamist meditsiinisüsteemis.

Geneetikal on tänapäeva meditsiini laiendamisel suur potentsiaal, eriti arvestades tehnoloogia kiiret arengut viimase aastakümne jooksul. Nüüdseks on võimalik analüüsida rohkem kui miljonit geneetilist varianti (nn geenikaardi genereerimine) vaid saja euroga. Praegu suudame küll tõlgendada vaid osa nendest variantidest, aga kuna need elu jooksul üldiselt ei muutu, on geneetilise informatsiooni inkorporeerimisel meditsiinisüsteemi võimalik iga aastaga järjest rohkem seda informatsiooni tõlgendada viisil, mis aitab arstidel patsientide riske hinnata. Seda nii haiguste varajaseks ennetamiseks kui ka ravimite määramiseks.
Välisinvestorite huvi
E-riigil Eestil on nüüd võimalus olla ülimalt uuenduslik, viies kokku maailma geneetikute seas väga kõrgelt hinnatud Eesti geenivaramu ja suure potentsiaaliga e-Tervise süsteemi. On arusaadav, et Eestil pole kusagilt võtta kümneid miljoneid eurosid, et järjestada kõigi 52 000 geenidoonori DNA (mis oleks ühtse riikliku süsteemi loomise alguspunkt) ning viia geenivariandid kokku olemasolevate tohutute terviseandmetega. Aga mõeldes sellele, et geenivaramuga võtavad järjest rohkem ühendust välisinvestorid, kes on vägagi huvitatud selle projekti rahastamisest – teades suurepäraselt, et tulevikus on võimalik see investeering mitmekordselt tagasi teenida –, on kahju, et me ise ei suuda seda projekti rahastada. See oleks Eestile hea võimalus tulevikku investeerida. Kui see aga ka nii ei lähe, annab paljude potentsiaalsete rahastajate olemasolu võimaluse hoolega valida, millised partnerlustingimused sobivad eesmärgiga tõhustada Eesti tervishoiusüsteemi ja minna edasi nii, et võimalikult palju innovatsiooniga seotud tööd tehtaks ära Eestis, kaasates kõiki siinolevaid talente ja kutsudes veel mõned lisaks koju tagasi.
1 Mega, J. L., Stitziel, N. O., Smith, J. G., Chasman, D. I., Caulfield, M. J., Devlin, J. J., … Sabatine, M. S. (2015). Genetic risk, coronary heart disease events, and the clinical benefit of statin therapy: an analysis of primary and secondary prevention trials. The Lancet. http://doi.org/10.1016/S0140-6736(14)61730-X
2 Talmud, P. J., Cooper, J. A., Morris, R. W., Dudbridge, F., Shah, T., Engmann, J., … Humphries, S. E. (2015). Sixty-five common genetic variants and prediction of type 2 diabetes. Diabetes. http://doi.org/10.2337/db14-1504